 II. Le dispositif expérimental utilisé :
II. Le dispositif expérimental utilisé :- Observer l’évolution du pH d’un même volume de différentes solutions d’acides (de même concentration) dans lesquelles on verse progressivement une solution de soude de même concentration.
- comparer les différentes réactions.
- trouver une application pratique au protocole.
 II. Le dispositif expérimental utilisé :
II. Le dispositif expérimental utilisé :|
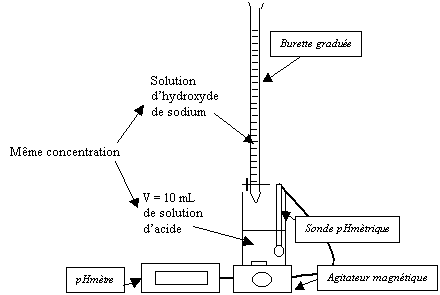
La solution d’hydroxyde de sodium est placée dans une burette graduée (préalablement rincée avec la solution). Son niveau est ajusté au zéro en prenant garde au ménisque. Un volume V = 10 mL de solution d’acide mesuré à la pipette jaugée est placé dans un bécher, sous la burette, au-dessus d’un agitateur magnétique. Un barreau aimanté est placé dans le bécher. On verse mL par mL, la solution d’hydroxyde de sodium dans le bécher et on mesure à l’aide d’un ph-mètre étalonné le pH du mélange pour chaque mL versé. |
|
Solution d’acide chlorhydrique de concentration c = 0,1 mol/L
Solution d’acide éthanoïque de concentration c = 0,1 mol/L
Solution d’acide benzoïque de concentration c = 0,1 mol/L
Les graphiques seront tracés à l’aide du logiciel Regressi.
Comparer les différents graphes.
Ecrire les équations chimiques des réactions acide-base.
Exprimer et calculer les constantes de réaction dans les 3 cas.
Les réactions sont-elles totales ?
Compte-tenu des données expérimentales, pour quel volume de soude versée les réactifs sont-ils dans les proportions stœchiométriques ?
A quel point de chaque graphique correspond-il ?
Décrire la forme des graphes autour de ce point.
Faire superposer à chacun des graphiques le tracé de pH’ = f(Vsoude)
En déduire une application pratique de ce protocole.
Cas de l’acide chlorhydrique :

Cas de l’acide éthanoïque
