Dans cette partie concernant la cinétique des réactions chimiques, les réactions chimiques étudiées seront des réactions d'oxydoréduction mettant en jeu des antiseptiques courants.
Etudier l'évolution de la vitesse de formation au cours du temps.
La réaction étudiée est la réaction d'oxydoréduction (totale) qui se produit entre l'eau oxygénée H202 (incolore) et les ions iodure I- (incolores en solution). L'un des produits formés (I2) est coloré. L'intensité de la coloration brune de la solution qui le contient dépend de sa concentration. On peut donc suivre l'évolution de la concentration en I2 au cours du temps en suivant l'évolution de la coloration de la solution.
L'évolution de la coloration de la solution sera suivie en mesurant l'absorbance A de la solution à l'aide d'un colorimètre.
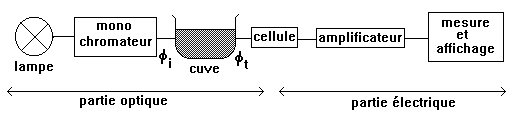
Les différents colorimètres existants sont conçus avec la même organisation générale:

La partie optique comprend une source de lumière blanche qui éclaire un monochromateur (il permet la sélection d'un faisceau monochromatique (une seule longueur d'onde l ou couleur)).
Le faisceau sélectionné traverse une cuve contenant la solution étudiée et atteint la cellule de mesure.
La partie électrique comprend une diode sensible à la lumière (photodiode) qui débite un courant proportionnel au flux lumineux qu'elle reçoit. Ce courant est amplifié et traverse un circuit intégré donnant une tension proportionnelle au flux lumineux reçu. L'appareil de mesure est donc un voltmètre. Le résultat de la mesure n'est pas directement la tension mesurée ni le flux lumineux dont elle dérive mais une grandeur A appelée absorbance (ou densité optique).
Pour définir l'absorbance, considérons un faisceau lumineux incident de flux fi qui traverse une substance et émerge avec un flux transmis ft (ft < fi). L'absorbance est le nombre sans dimension A = log (fi / ft).
La loi expérimentale de BEER-LAMBERT qui relie A à la concentration c de la substance colorée est la suivante :
c = k(l). A
où k(l) (en mol.L-1) est constant pour une longueur d'onde l fixée.
On détermine k(l) par des mesures d'absorbance pour des solutions de concentrations connues (étalonnage).
On choisit l de façon à observer un maximum d'absorption de la solution considérée. Cette sélection est faite à l'aide d'une série de filtres monochromatiques. On prendra le filtre de l = 470 nm.
Ne pas tenir les cuve par les faces qui seront éclairées dans le colorimètre (les traces de doigts perturbent les mesures d'absorbance)
Ne pas faire couler de solution dans le compartiment de mesure.
- Allumer le colorimètre (12 v continu) et placer le filtre convenable
- Régler le "blanc" à zéro ; placer la cuve contenant une solution d'iodure de potassium (incolore) de concentration 0,20 mol.L-1. Mettre le cache noir pour éviter les lumières parasites. Appuyer sur "zéro" ou "R". Conserver cette préparation.
- Etalonnage : mesurer l’absorbance de quelques solutions de concentrations en I2 connues et en déduire le coefficient k(l) pour le filtre choisi.
- reprendre la cuve contenant 2 mL de solution d'iodure de potassium (c1 = 0,20 mol/L)
- préparer une seconde cuve avec 2 mL d'eau oxygénée acidifiée (c2 = 1,0 .10-2 mol/L)
- mélanger les 2 réactifs, placer immédiatement la cuve contenant le mélange dans le colorimètre et simultanément déclencher le chronomètre. Mesurer l’absorbance de la solution toutes les minutes (30 secondes pour les plus organisés) pendant environ 30 minutes
Noter la valeur du maximum d'absorbance indiquée par le colorimètre : Amax =
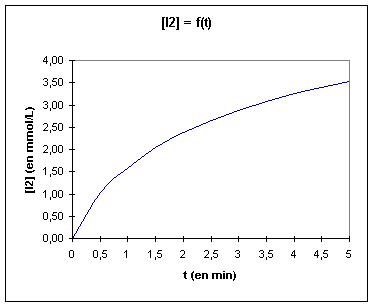
A l’aide d’un tableur, tracer l’évolution de [I2] au cours du temps
Ecrire et équilibrer le bilan de la réaction rédox étudiée. Parmi les réactifs quel est l'oxydant? quel est le réducteur?
On donne les potentiels standards des couples H2O2/H2O (E° = 1,77 V) et I2/I- (E° = 0,62 V). Justifier la nécessité d'acidifier le milieu.
Calculer les quantités de chaque réactif introduit dans le mélange. Quel est le réactif limitant?
Calculer la valeur de la concentration en I2 maximale ([I2]max) que l'on pourra obtenir en fin de réaction.
On appelle temps de demi-réaction t, le temps au bout duquel la moitié du réactif limitant a été consommée. Déterminer graphiquement t.
Par analogie avec la mécanique, on définit la vitesse volumique moyenne d'apparition du diiode entre 2 instants t1 et t2 comme le rapport : vt1®t2(I2) = ([I2])t2 - [I2])t1)/(t2-t1) (elle s'exprime en mol.L-1.s-1).
Par extension, la vitesse volumique instantanée, à un instant t0 donné est vt0(I2) = d([I2]t0)/dt
Evaluer graphiquement la vitesse volumique d'apparition de I2 aux instants t1 = 3 min.; t2 = 6 min. ; t3 = 9 min.
Commenter les résultats obtenus.
H2O2 + 2H+ + 2e-® 2 H2O
2 I- ® I2 + 2 e-
H2O2 + 2H+ + 2I- ® 2 H2O + I2
Quantités introduites dans le mélange initial :V1 = 2 mL d'iodure de potassium de concentration c1 = 0,2 mol.L-1 V2 = 2 mL d'eau oxygénée acidifiée de concentration c2 = 0,01 mol.L-1 n1 = c1x V1 = 4.10-4 mol n2 = c2x V2 = 2.10-5 mol n2 < n1/2 donc I- est en excès |
Quantités qui réagissent et quantités formées en fin de réaction :L'eau oxygénée réagit totalement n2 = 2.10-5 mol avec n1 = 2n2 = 4.10-5 mol de I- . Il se forme en fin de réaction n3 = n2 = 2.10-5 mol de I2 [I2]max = n3 / Vtotal = 2.10-5/4.10-3 = 5. 10-5 mol.L-1 |
|
t (min) |
A (x103) |
[I2] (mmol/L) |
Mesures de vitesses :vt1®t2(I2) = ([I2])t2 - [I2])t1)/(t2-t1) (en mol.L-1.s-1). vt0(I2) = d([I2]t0)/dt C'est au début de la réaction que la vitesse est la plus grande ; elle diminue progressivement jusqu'à s'annuler. Temps de demi-réaction :t est le temps au bout duquel la moitié du réactif limitant a été consommée. t = 2,2 min = 2 min 10s |
|
0 |
0 |
0,00 |
|
|
0,5 |
220 |
1,02 |
|
|
1 |
340 |
1,58 |
|
|
1,5 |
440 |
2,05 |
|
|
2 |
510 |
2,37 |
|
|
2,5 |
570 |
2,65 |
|
|
3 |
620 |
2,88 |
|
|
3,5 |
660 |
3,07 |
|
|
4 |
700 |
3,26 |
|
|
4,5 |
730 |
3,39 |
|
|
5 |
760 |
3,53 |