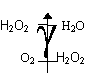 1°)
La réaction étudiée :
1°)
La réaction étudiée :Un catalyseur est une substance qui accélère une réaction spontanée.
L'état final de la réaction est inchangé. Son bilan reste le même.
La catalyse est l'action d'un catalyseur sur une réaction.
On parle de catalyse homogène lorsque le catalyseur et les réactifs ne forment qu'une seule phase (liquide ou gaz).
On parle de catalyse hétérogène lorsque le catalyseur et les réactifs forment plusieurs phases (solide-liquide ou solide-gaz).
La catalyse enzymatique est un cas particulier de catalyse homogène où le catalyseur est une enzyme (protéine élaborée par les systèmes vivants).
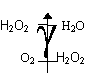 1°)
La réaction étudiée :
1°)
La réaction étudiée :Il s'agit de la dismutation de l'eau oxygénée :
Ecrire son bilan :
Cette réaction est très lente, puisque l'eau oxygénée se conserve, à température ambiante et à l'abri de la lumière, assez longtemps.
La dismutation de l'eau oxygénée est catalysée par Fe3+ ou Fe2+ , le dégagement gazeux est alors visible. Le vérifier. Identifier le dégagement gazeux.
Montrer que la quantité du catalyseur a une influence.
(autres exemples de catalyse homogène : I- et S2O82- catalysée par Fe2+ )
Dismutation de l'eau oxygénée en présence de platine.
Cas d'un fil de platine
Cas d'un disque de platine platiné.
Vérifier que le catalyseur offrant la plus grande surface est le plus efficace.
La catalyse enzymatique est un cas particulier de catalyse homogène où le catalyseur est une enzyme (protéine élaborée par les systèmes vivants). Cas de la dismutation de l'eau oxygénée en présence de catalase (enzyme du sang ou du navet).
Une réaction s'autocatalyse lorsqu'elle est catalysée par l'un des produits qu'elle engendre.
La réaction entre MnO4- et H2C2O4 (acide oxalique) est catalysée par Mn2+.
Expérience :

Etude de cette réaction : les couples rédox mis en jeu sont MnO4-/Mn2+ et CO2/H2C2O4.
Ecrire l'équation-bilan :
Etude cinétique :
Seul MnO4- est coloré. On suivra donc l'évolution de la réaction à l'aide d'un colorimètre. On rappelle que la concentration c en substance colorée est proportionnelle à l'absorbance A : c = k. A
- Allumer le colorimètre (12 v continu) et placer le filtre vert sur le support.
- Régler le "blanc" à zéro ; placer la cuve contenant une solution d'acide oxalique (incolore) de concentration 5,0.10-2 mol.L-1. Mettre le cache noir pour éviter les lumières parasites. Appuyer sur "zéro".
- Etalonner le colorimètre en mesurant l'absorbance de 2 solutions de permanganate de potassium de concentrations connues (5,0 mmol.L-1 et 2,5 mmol.L-1).
- Préparer dans une première cuve 2 mL d'acide oxalique de concentration c1 = 5,0.10-2 mol.L-1
- Préparer dans une deuxième cuve 3 mL de solution de permanganate de potassium acidifié de concentration c2 = 5,0 mmol.L-1
- Mélanger les 2 réactifs et déclencher le chronomètre. Placer le mélange dans le colorimètre. Ne pas oublier le cache noir.
- Noter la valeur de l'absorbance toutes les 10 s pendant 3 minutes.
|
t (s) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
110 |
120 |
130 |
140 |
150 |
160 |
170 |
180 |
|
A |
|||||||||||||||||||
|
[MnO4-] mmol/L |
Tracer [MnO4-] en fonction du temps.
Comment varie la vitesse de disparition des ions MnO4- au cours de l'expérience?
La propriété de diminution de la vitesse quand la concentration des réactifs diminue paraît-elle vérifiée? quelle serait l'allure de la courbe si tel était le cas?