
Ce TP sera l'occasion de se familiariser avec la verrerie, les solvants, les procédés spécifiques à la chimie organique.
L'utilisation de becs bunsen est proscrite du fait du caractère inflammable des composés organiques.
Il s'agit d'extraire par hydrodistillation[1] une huile essentielle contenue dans la peau d'orange, de séparer par décantation[2] les différentes phases[3] du distillat[4] et d'identifier un constituant le l'huile essentielle par chromatographie.
|
Préparation au laboratoire (pour chaque groupe): Laver soigneusement 2 oranges afin d'éliminer les conservateurs pulvérisés sur les agrumes. Les éplucher puis découper la peau en petits morceaux. Placer ces morceaux dans 300 mL d'eau tiède. Laisser macérer quelques minutes, broyer le mélange. Verser la décoction dans le ballon. En classe: Faire circuler l'eau froide dans le réfrigérant (attention au sens!) et porter le mélange à ébullition. Recueillir environ 30 mL de distillat. Au cours de la distillation, la température de la phase gazeuse reste inférieure à 100°C. Légender le schéma ci-contre. Décrire le distillat: phases, couleur, odeur... |
Dispositif pour l'hydrodistillation: |
Verser la totalité du distillat dans une ampoule à décanter. Rincer l'éprouvette qui le contenait avec environ 20 mL de solution saturée de chlorure de sodium et verser cette solution dans l'ampoule à décanter (la présence des ions Na+ et Cl- diminue encore la solubilité déjà très faible des composés organiques dans l'eau).
Ajouter 5 mL de dichlorométhane (solvant de la phase organique).
Agiter, après l'avoir bouchée, l'ampoule (robinet vers le haut) pendant au moins 3 minutes. Ouvrir de temps en temps le robinet pour soulager d'éventuelles surpressions.
Laisser décanter puis recueillir la phase organique dans un petit bécher. Cette phase contient l'huile essentielle.
Justifier la position relative de la phase organique et de la phase aqueuse dans l'ampoule à décanter. Aurait-on observé la même disposition avec le cyclohexane comme solvant organique?
Masses volumiques en kg.L-1: dichlorométhane: 1,33; cyclohexane: 0,78.
Lorsqu'on dépose un mélange liquide sur un support solide finement divisé, la vitesse d'entraînement de chaque constituant par un solvant (éluant) se déplaçant par capillarité le long du support dépend du constituant. Cette technique permet de séparer les constituants du mélange et de les identifier grâce à leur vitesse de déplacement.
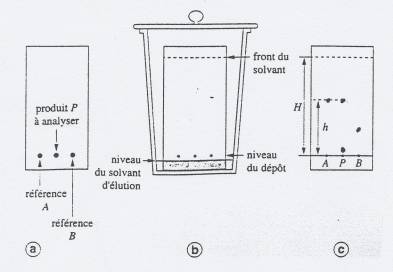
La cuve peut être un bécher haut, de 250mL par exemple, tapissé sur les trois quarts de sa surface intérieure par un morceau de papier filtre. L'éluant est du cyclohexane. Verser l'éluant dans cette cuve: on doit avoir environ 5 mm d'éluant en fond de cuve. Boucher la cuve avec une boîte de Pétri renversée. Attendre 10 minutes pour que la cuve soit bien saturée en vapeurs de solvant.
On dépose un échantillon sur une plaque (silice déposée sur aluminium par exemple : c'est la phase fixe).
- Découper une plaque de 6 cm x 9 cm.
- Tracer au crayon graphite une ligne fine à 1 cm du bas de cette plaque.
- Sur cette ligne, tracer à 1,5 cm du bord gauche un point, puis un second point à 1,5cm du précédent, puis un troisième point à 1,5cm du précédent.
- A l'aide d'une pipette Pasteur ou d'un capillaire, déposer une goutte des échantillons à comparer sur les points tracés sur la plaque (le diamètre de la tache doit être inférieur à 5 mm). S'exercer sur un papier filtre ordinaire au préalable.
Attention: utiliser une pipette différente pour chaque solution.
- 1er point: solution A: 2 gouttes huile essentielle obtenue par hydrodistillation + 1,5 mL de dichlorométhane
- 2ème point: solution B: 1 goutte d'huile essentielle d'orange vendue en pharmacie + 1,5 mL de dichlorométhane
- 3ème point: solution C: 1 goutte de limonène pur dans 2 mL de cyclohexane.
Attendre que chaque tache sèche; en déposer éventuellement une ou plusieurs autres au même endroit en cas d'échantillon très dilué (cas de la solution A: déposer 3 gouttes).
Placer cette plaque, ligne de départ vers le bas, dans la cuve contenant l'éluant. L'élution commence : l'éluant monte par capillarité le long de la plaque et entraîne les composés dissous dans l'échantillon à une vitesse qui dépend de la nature du composé : la rétention de chaque composé sur la silice de la plaque dépend de sa nature chimique. Lorsque l'éluant est suffisamment monté (jusqu'à 1 cm du bord supérieur), ce qui prend entre 5 et 10 minutes, sortir la plaque de la cuve et repérer la hauteur maximale H atteinte par l'éluant. Attendre que la plaque sèche.
Il s'agit maintenant de "lire" le chromatogramme en repérant les constituants à analyser sur la plaque. Deux cas se présentent :
- les constituants sont colorés: la révélation est immédiate.
- les constituants sont invisibles : il faut les faire apparaître. On utilise alors un révélateur chimique approprié ou on éclaire la plaque (contenant un activateur fluorescent ajouté par le fabricant) avec une lampe UV. Le révélateur sera ici du permanganate de potassium à 0,02 mol/L contenue dans un cristallisoir. Corner un coin supérieur de la plaque et, en la tenant par ce coin, la poser, silice en dessous sur la solution de permanganate de potassium de manière à mouiller toute la surface en une fois. Retirer la plaque, l'égoutter en position verticale sur du papier filtre. Les substances oxydées par le permanganate apparaissent sous forme de tâches jaunes sur fond rose. Les entourer rapidement.
Identifier le limonène par comparaison. Mesurer la hauteur h parcourue par le limonène à partir de la ligne de départ et calculer le rapport frontal Rf =h/H du limonène.
Attention: Rf dépend du constituant, de l'éluant, de la nature de la phase fixe, les Rf sont difficilement reproductibles.
Comparer les taches obtenues dans les 3 cas et conclure sur les trois solutions.


[1] Hydrodistillation: distillation d'un mélange hétérogène d'eau et de liquide organique non miscible à l'eau (entraînement à la vapeur).
Distillation: Opération qui consiste à porter un mélange liquide à ébullition puis à condenser les vapeurs. La vapeur est plus riche que le mélange liquide en composé le plus volatil. Le distillat est donc aussi plus riche en composé volatil.
Composé volatil : Plus la température d'ébullition d'un corps est basse, plus il est volatil.
Température d'ébullition: Température à laquelle un corps pur passe de l'état liquide à l'état gazeux. A pression constante, la température d'ébullition d'un corps pur est fixe.
[2] Décantation: action de séparer les différentes phases d'un mélange
[3] Phase: partie homogène d'un système. La phase aqueuse est la partie du système contenant l'eau; la phase organique est la partie contenant les composés organiques; ces 2 phases ne sont pas miscibles.
[4] Distillat: produit d'une distillation (vapeurs recondensées).