
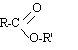 1°)
Rappels sur les esters:
1°)
Rappels sur les esters:Il s'agit de l'éthanoate de 3-méthylbutyle (acétate d'isoamyle). Il est présent dans les huiles essentielles d'eucalyptus, de jasmin et de bergamote. Il a une odeur fruité de banane ou de poire très caractéristique (odeur dite de "bonbon anglais"). Il est utilisé principalement comme arôme alimentaire et, à très faible dose en parfumerie.

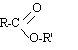 1°)
Rappels sur les esters:
1°)
Rappels sur les esters:|
groupe caractéristique : groupe carboxylique (plan): |
Formule générale d'un ester: ou RCOOR' (avec R'différent de H) |
Acide carboxylique + alcool Á ester + eau
Son bilan général est du type : RCOOH + R'-OH Á RCOOR' + H2O
La réaction est très lente dans les conditions habituelles (nécessité de chauffer, de catalyser)
La réaction est limitée. Il reste toujours de l'acide et de l'alcool dans le mélange final. L'équation-bilan s'écrit donc avec une Á.
Questions:
1°) Ecrire la formule semi-développée de l'éthanoate de 3-méthylbutyle.
2°) Ecrire les formules semi-développées et nommer selon la nomenclature officielle l'acide et l'alcool utilisés pour former cet ester.
3°) Ecrire l'équation-bilan de la réaction d'estérification.
1. Sous la hotte, dans un ballon de 100 mL, on a préalablement introduit:
2. Mélanger les produits en les faisant "tourner dans le ballon" (attention!).
3. Adapter le réfrigérant à reflux et, après avoir établi la circulation d'eau, chauffer à reflux pendant une demi-heure. Le chauffage à reflux permet d'éviter que les constituants du mélange réactionnel ne s'évaporent au cours d'un chauffage prolongé.
Surveiller régulièrement; en cas de surchauffe remonter le montage pour sortir le ballon du chauffe ballon.
4. Arrêter le chauffage, refroidir l'extérieur du ballon sous l'eau froide sans arrêter la circulation d'eau dans le réfrigérant.
5. Verser le contenu du ballon dans un bécher de 250 mL contenant environ 100 mL d'eau glacée. Rincer le ballon avec un peu d'eau à verser dans le bécher. Agiter.
6. Transvaser dans une ampoule à décanter, ajouter 10 mL d'une solution saturée de chlorure de sodium, écarter la phase aqueuse après décantation.
7. Recueillir la phase organique dans un bécher de 250 mL. Y ajouter par petites quantités, tout en agitant vivement, environ le contenu d'un tube à essai d'une solution basique de carbonate de sodium, jusqu'à l'obtention d'un pH voisin de 7 (vérif. au papier pH)
8. Après cessation du dégagement gazeux, décanter à nouveau et écarter la phase aqueuse.
9. Laver la phase organique avec environ 25 mL d'une solution saturée de chlorure de sodium. Décanter, écarter la phase aqueuse.
10. Recueillir la phase organique dans un erlenmeyer, y ajouter environ 3 g de sulfate de magnésium anhydre pour éliminer les traces d'eau. Boucher et agiter. Recueillir le liquide surnageant dans un erlenmeyer préalablement taré.
11. Peser la phase organique finale.
Questions:
1°) Faire le schéma annoté du montage de chauffage à reflux.
2°) Quel est le rôle du réfrigérant à boules ? Quel est le rôle de la pierre ponce ? Quel est le rôle de l'acide sulfurique ?
3°) Pourquoi chauffe-t-on le mélange ?
4°) Les réactifs sont-ils équimolaires ? Pourquoi ? Quel est le réactif en excès ?
5°) Quel est le rôle du carbonate de sodium lors de l'extraction ? Quel gaz se dégage-t-il ? Ecrire les équations-bilans correspondantes.
6°) Compte tenu du protocole, que contient, selon vous, la phase organique finale ?
7°) Evaluer le rendement de cette réaction. Critiquer le résultat.
Données physiques :
|
acide |
alcool |
ester |
||
|
densité |
1,05 |
0,81 |
0,87 |
|
|
solubilité dans l'eau |
oui |
partielle |
non |
|
|
température d'ébullition |
118°C |
130°C |
142°C |
|
|
masse molaire |
60 g.mol-1 |
88 g.mol-1 |
130 g.mol-1 |
Synthèse d'un ester: correction
I. L'ester préparé:
Formule semi-développée de l'éthanoate de 3-méthylbutyle

Formules semi-développées et noms de l'acide et l'alcool utilisés.
![]()

acide éthanoïque 3-méthylbutan-1-ol
Equation-bilan de la réaction d'estérification :
![]() +
+  Á
Á
 + H2O
+ H2O
II. Questions sur le TP:
|
1°) Schéma annoté du montage de chauffage à reflux (nous avons utilisé un réfrigérant à boules pour augmenter la surface d'échange lors du refroidissement). |
Réfrigérant à boules
|
2°) Le réfrigérant condense les vapeurs du mélange qui se forment lors du chauffage. Cela permet de chauffer longuement sans perdre les composants du mélange réactionnel par évaporation.
La pierre ponce sert à l'agitation du mélange afin d'homogénéiser la température
L'acide sulfurique est un catalyseur de l'estérification (H+)
3°) La réaction d'estérification est très lente à température ambiante, c'est pourquoi on chauffe le mélange (facteur cinétique).
4°) Quantité d'acide éthanoïque :µ = µeau.d = 1000.1,05 = 1050 g/L
m = µ.V = 1050.30.10-3 = 31,5 g
n = m/M = 31,5/60 = 0,525 mol
Quantité d'alcool :µ = µeau.d = 1000.0,81 = 810 g/L
m = µ.V = 810.10.10-3 = 8,1 g
n = m/M = 8,1/88 = 0,092 mol
Le mélange réactionnel n'est pas équimolaire, l'acide éthanoïque est en excès.
5°) Le carbonate de sodium (basique) neutralise les H+ résiduels et transforme les molécules d'acide éthanoïque non dissociées (acide faible) en ions éthanoate.
Le gaz qui se dégage est le dioxyde de carbone.
CO2 ,H2O / pKa = 6,4 / pKa=10,3
Réaction entre un acide et l'ion ![]() :
:
![]() + HA Á
+ HA Á
![]() + A-
+ A-
Réaction entre un acide et l'ion ![]() :
:
 + AH Á
CO2 + H2O + A-
+ AH Á
CO2 + H2O + A-
6°) la phase organique finale contient l'ester pratiquement pur ; du fait de l'excès d'acide éthanoïque, l'alcool a été complètement consommé ; toutes les autres substances ont pu être écartées avec la phase aqueuse et la phase organique a été séchée.
7°) La masse d'ester obtenue est de 8 g ; la masse espérée est de nalccol.Mester = 0,092 .130 = 11,96 g (car l'alcool est le réactif limitant); le rendement est donc 9/11,96 = 75 %.
La réaction n'est peut-être pas totale ou bien le protocole a conduit à perdre lors des phase de lavage, une partie de l'ester formé.