Les savons - TP: Saponification
d'une huile - Fabrication d'un savon
I. Objectifs:
Fabriquer un savon. Mettre en évidence les propriétés chimiques des savons.
II. Principe:
La fabrication d'un savon résulte d'une réaction de saponification entre une base forte et un ester. C'est une réaction totale.
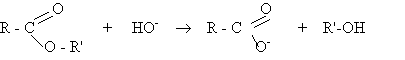
Le savon (type savon de Marseille) s'obtient par action d'hydroxyde de sodium ( Na+; HO- ) sur un triester d'acide gras et du glycérol (propan-1,2,3-triol).
Exemples d'acides gras:
|
acide |
Formule |
Formule demi-développée |
|
butyrique |
C4H9COOH |
CH3-CH2-CH2-CH2-COOH |
|
oléique |
C17H33COOH |
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-COOH |
|
linoléique |
C17H31COOH |
CH3-CH2-CH2-CH2-CH2-CH=CH-CH2-CH=CH-CH2-CH2-CH2-CH2-CH2-CH2-CH2-COOH |
Ecrire les formules des triesters dérivant de ces acides gras et du glycérol.
Ecrire l’équation-bilan de la saponification de l’oléine
III. Manipulation:
1°) Saponification:
|
Placer dans un erlenmeyer de 250 mL: - 20 mL de soude à 5 mol.L-1 - 10 g d'huile - 10 mL d'éthanol Chauffer à reflux entre 150°C et 200°C sur une plaque en agitant. Préparer les tubes
pour les manipulations 3°) et 4°) en surveillant. |
Faire le schéma du dispositif expérimental |
2°) Relargage et filtration:
|
Verser le mélange chaud dans un bécher de 250 mL contenant 100 mL d'eau salée (à 200 g/L) et froide. Agiter. Filtrer sur un filtre Büchner, rincer avec 20 mL d'eau distillée. Récupérer le savon sur une coupelle. |
Faire le schéma du dispositif expérimental |
Ne pas l'utiliser
pour se laver les mains, il contient encore de la soude caustique!
3°) Etude du filtrat:
Préparer 4 tubes à essais:
- tube 1: 1 mL d'eau distillée + 1 goutte de glycérol
- tube 2: 1 mL de soude (à 0,10 mol.L-1)
- tube 3: 1 mL de soude (à 0,10 mol.L-1) + 1 goutte de glycérol
- tube 4: 1 mL de filtrat
Ajouter à chaque tube quelques gouttes de solution de sulfate de cuivre II (à 0,10 mol.L-1). Noter les observations. Conlure sur la composition du filtrat.
4°) Pouvoir détergent d'un savon:
L'expérience montre qu'un savon qui mousse a de bonnes propriétés détergentes. Comparons les pouvoirs moussants de 3 solutions :
- solution 1: 5 mL d'eau distillée
- solution 2: 5 mL d'eau distillée + quelques gouttes de mir
- solution 3: 5 mL d'eau distillée savonneuse
Ajouter 5 gouttes d'huile à chaque tube. Agiter vigoureusement. Comparer les pouvoirs moussants des solutions.
5°) Influence de la dureté de l'eau sur lepouvoir détergent d'un savon:
Une eau dure contient des ions calcium et/ou magnésium.
- tube 1: 1 mL d'eau distillée
- tube 2: 1 mL de solution de chlorure de calcium
- tube 3: 1 mL de solution de chlorure de magnésium
Ajouter à chaque tube quelques gouttes de mir. Agiter vigoureusement. Comparer les pouvoirs moussants des solutions.
Conclure.