 Quelles sont
les fonctions organiques de cette molécule ? Est-elle chirale ?
Quelles sont
les fonctions organiques de cette molécule ? Est-elle chirale ?- réviser les techniques de dosage acido-basiques
- vérifier la teneur en acide acétylsalicylique d'un comprimé d'aspirine.
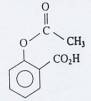
L'acide acétylsalicylique, a pour formule chimique :
 Quelles sont
les fonctions organiques de cette molécule ? Est-elle chirale ?
Quelles sont
les fonctions organiques de cette molécule ? Est-elle chirale ?
Un litre de solution a été préparé, dans une fiole jaugée, par dissolution de 4 comprimés d'aspirine simple "500".
Remarque: l'aspirine est peu soluble dans l'eau, la préparation de cette solution nécessite une longue agitation.
Prélever 100 mL de cette solution et la verser dans un bécher placé sur un agitateur magnétique.
Remplir la burette graduée avec la solution d'hydroxyde de sodium de concentration cB = 0,10 mol.L-1.
Etalonner le pHmètre et réaliser le dosage pHmétrique en complétant un tableau comme ci-dessous:
|
VB (mL) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
9.5 |
10 |
10.5 |
11 |
11.5 |
12 |
13 |
14 |
15 |
16 |
|
pH |
Ecrire l'équation-bilan du dosage acido-basique et montrer qu'elle est quantitative.
Cette réaction entre l'acide acétylsalicylique et la soude n'est pas la seule possible. Quelle autre réaction peut se produire ? Pourquoi n'en tient-on pas compte ici ?
Tracer le graphe pH = f(VB) et déterminer le point d'équivalence. Retrouver, d'après le graphe, la valeur du pKA du couple acide acétylsalicylique/ion salicylate.
Calculer la concentration en aspirine de la solution dosée. D'après la notice, un comprimé contient 500 mg d'acide acétylsalicylique vérifier cette information.
Quel indicateur aurait-on pu utiliser pour un dosage colorimétrique ?
Données sur l'acide acétylsalicylique: pKA = 3,8; M = 180 g.mol-1
Zone de virage de quelques indicateurs:
|
hélianthine |
[3,1 - 4,4] |
BBT |
[6,0 - 7,6] |
phénolphtaléine |
[8,2 - 10] |
a-naphtolphtaléine |
[7,5 - 8,6] |
Placer un comprimé d'aspirine 500 dans un erlenmayer. Y ajouter 10 mL de solution de soude à 1,0 mol.L-1 puis 15 mL environ d'eau distillée.
Chauffer sur un agitateur chauffant jusqu'au voisinage de l'ébullition pendant 10 minutes. Laisser refroidir.
Transvaser la solution limpide obtenue dans une fiole jaugée de 250 mL. Rincer soigneusement l'erlenmayer à l'eau distillée et ajouter les eaux de rinçage au contenu de la fiole. Compléter à l'eau distillée jusqu'au trait de jauge. Homogénéiser la solution.
Prélever 20 mL de cette solution et la verser dans un bécher placé sur un agitateur magnétique. Y ajouter 4 à 5 gouttes de phénolphtaléine
Remplir la burette graduée avec une solution d'acide chlorhydrique de concentration cA = 5,0 .10-2 mol.L-1.
En agitant en permanence, procéder à l'addition rapide d'acide jusqu'à l'obtention d'une coloration rose clair, puis ajouter l'acide goutte à goutte en agitant bien entre 2 gouttes. Noter le volume versé jusqu'à la décoloration complète.
Ecrire l'équation chimique de la réaction effectuée lors du chauffage en présence de soude.
Ecrire l'équation chimique du dosage acido-basique et la relation à l'équivalence.
Calculer, d'après le résultat du dosage la quantité nB d'ions HO- présents dans le prélèvement de 20 mL .
En déduire la quantité n1 d'ions HO- présents dans la fiole de 250 mL.
Quelle est la quantité n2 d'ions HO- ajoutés au comprimé? En déduire la quantité n3 d'ions HO- qui ont réagi avec l'aspirine puis la quantité d'aspirine qui été consommée par cette réaction. En déduire enfin la masse d'acide acétylsalicylique dans un comprimé.
Comparer aux données et au résultat du premier dosage conclure.