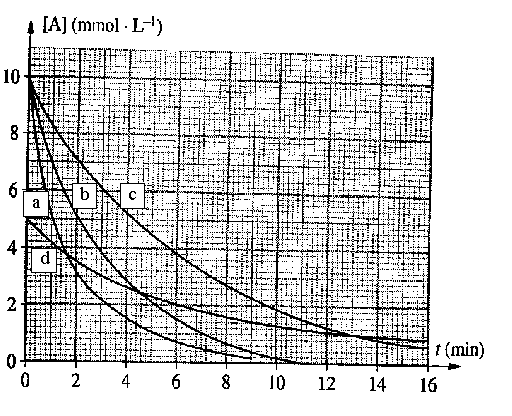
|
Texte support de l'interrogation orale
Les questions en gras portent sur le
matériel exposé
L'usage de la calculatrice est interdit.
|
Commentaires
et
questions possibles pour aider le candidat
Les questions en gras portent sur le
matériel exposé.
|
Compétences exigibles
|
|
1. On étudie le mouvement d'une particule (masse m, charge
q> 0) qui se déplace dans un champ magnétique uniforme de valeur B.
On néglige les effets du poids de la particule.
- Quelle est l'expression vectorielle de la force magnétique
subie par la particule ?
- Établir l'expression de son vecteur accélération.
2. L'énergie cinétique de la particule est-elle modifiée
lorsqu'elle se déplace dans le champ magnétique ? Justifier.
3. On a réalisé deux expériences : pour l'une la
particule possède un vecteur vitesse initiale 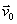 perpendiculaire à perpendiculaire à  , pour l'autre , pour l'autre 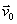 est parallèle à est parallèle à  . Dans quel cas la
trajectoire est-elle rectiligne ? Dans quel cas est-elle circulaire ?
Justifier. . Dans quel cas la
trajectoire est-elle rectiligne ? Dans quel cas est-elle circulaire ?
Justifier.
4. Dans le cas d'une trajectoire circulaire le rayon du
cercle est donné par la relation : R =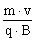 . .
Démontrer cette relation.
5. Avant l'introduction dans la zone où règne le champ
magnétique, la particule a été accélérée. Par quel type de champ ?
Comment peut-on le créer ?
|
Une particule a un mouvement circulaire et uniforme.
- Est ce que la valeur du vecteur vitesse change au cours
du temps ?
- Le vecteur vitesse change-t-il au cours du temps ?
- Le vecteur accélération est-il nul ? non nul ?
constant au cours du temps ?
Justifier chaque réponse par une phrase et un schéma.
Énoncer le théorème du centre d'inertie (relation fondamentale
de la dynamique).
Énoncer le théorème de l'énergie cinétique.
Montrer un dispositif permettant d'obtenir un champ
magnétique uniforme.
Quel est l'appareil qui permet de mesurer B ?
|
- connaître l'expression de la force subie par une
particule chargée en mouvement dans un champ magnétique
- démontrer que le mouvement d'une particule dans
un champ magnétique uniforme perpendiculaire à sa vitesse initiale est
plan, uniforme et circulaire.
- justifier qu'un champ magnétique uniforme, contrairement
à un champ électrique, ne peut faire varier l'énergie cinétique d'une
particule chargée.
- connaître les caractéristiques du champ électrique
dans un condensateur plan.
- savoir énoncer et mettre en œuvre la relation fondamentale
de la dynamique et le théorème de l'énergie cinétique
- connaître les caractéristiques du vecteur vitesse
et du vecteur accélération d'une particule en mouvement circulaire et
uniforme.
- décrire un dispositif permettant d'obtenir un champ
magnétique uniforme.
|
|
Texte support de l'interrogation orale
Les questions en gras portent sur le
matériel exposé
L'usage de la calculatrice est interdit.
|
Commentaires
et
questions possibles pour aider le candidat
Les questions en gras portent sur le matériel exposé.
|
Compétences exigibles
|
|
1. Au cours d'une séance de travaux pratiques on a réalisé,
en présence d'un catalyseur, l'hydrolyse d'un ester de formule CH3-
COO-CH2-CH3.
Le mélange initial était composé de 0,25 mol d'ester,
de 0,25 mol d'eau et de quelques gouttes d'une solution d'acide sulfurique.
a. Écrire l'équation-bilan de la réaction, encadrer les
groupes fonctionnels de l'ester et des produits ; nommer réactifs et produits.
- Le montage réalisé par les élèves est un montage à
reflux : ballon rond adapté au chauffe ballon, surmonté d'un réfrigérant
vertical. Quel est son intérêt ?
Lors de l'interrogation, vous aurez à reconnaître ce
matériel parmi celui qui est présenté.
c. Quelles sont les espèces chimiques présentes dans le
milieu réactionnel après hydrolyse ?
2. Après hydrolyse, on refroidit le mélange puis on ajoute
de la soude en présence de phénolphtaléine.
Écrire les équations-bilan des réactions qui ont lieu.
Remarque : l'acide sulfurique se comporte comme
un acide fort dans ce mélange.
|
Quelle est la formule développée de l'ester ?
Quelles sont les espèces susceptibles de réagir avec la
soude ?
Comment s'appelle la réaction entre un ester et la soude ?
Quelles sont les caractéristiques de cette réaction ?
|
- reconnaître le groupe fonctionnel ester dans la
formule d'un composé organique.
- à partir de la formule semi-développée d'un ester,
retrouver les formules de l'acide carboxylique et de l'alcool correspondants.
- écrire l'équation-bilan d'une réaction d'hydrolyse.
- savoir que la réaction d'un ester avec l'eau est
limitée, lente.
- savoir que la vitesse de formation d'un corps augmente
avec la température.
- écrire l'équation-bilan d'une réaction de dosage.
|
 Vb (cm3)
Vb (cm3)