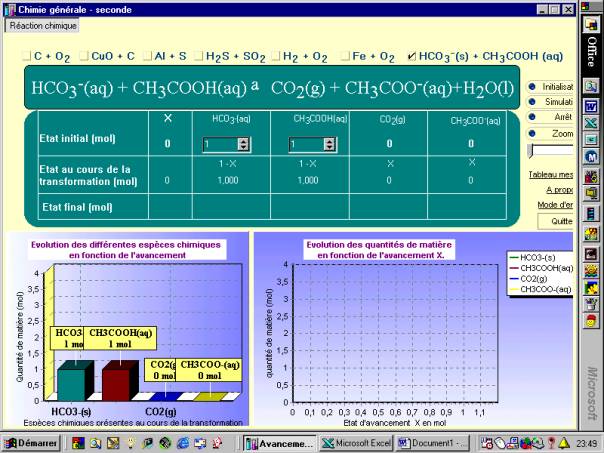
1°) Utiliser le logiciel et légender, sur ce schéma les zones actives

2°) Quel est l’état initial par défaut ?
3°) Montrer sur un exemple précis que le réactif limitant peut ne pas être celui présent initialement en moindre quantité.
4°) Comment les quantités de l’état final sont-elles calculées ?
5°) Comment l’avancement maximal est-il calculé ? Que se passe-t-il lorsqu’il est atteint ?
6°) Comment les pentes des droites qui se tracent au cours de l’avancement sont-elle calculées ? De quels paramètres dépendent leur valeur ? leur signe ? La modification de l’état initial, change-t-elle ces pentes ? Pourquoi ?
Exercice :
Le carbure de calcium CaC2 est une roche utilisée par les spéléologues dans leurs lampes.
Cette roche réagit avec de l’eau [réaction (1)] pour former de l’acétylène C2H2 et de l’oxyde de calcium CaO. L’acétylène est un gaz. C’est sa combustion dans l’air qui produit la lumière permettant d’éclairer les spéléologues. On rappelle que la combustion d’un hydrocarbure est sa réaction avec le dioxygène. Cette réaction produit du dioxyde de carbone et de l’eau [réaction (2)].
Ecrire et l'équilibrer les équations chimiques des deux réactions chimiques décrites.
Le spéléologue emporte avec lui 100 g de carbure de calcium et de l’eau en excès.
Construire les tableaux d’avancement des deux réactions en utilisant cette donnée sachant que le dioxygène de l’air en excès lui aussi. Pour les réactifs en excès, choisir une valeur possible.
Construire les 2 graphiques (histogramme et droites) concernant la combustion de l’acétylène (2ème réaction) pour les conditions initiales suivantes : n (C2H2) = 1,56 mol et n (O2) = 4,5 mol et lorsque l’avancement maximal est atteint.
Question complémentaire :
Si le volume molaire des gaz dans les conditions de l’expérience est de 24 L/mol, calculer le volume minimal d’air nécessaire à cette combustion complète.
Données : MH = 1,0 g.mol-1 MO = 16,0 g.mol-1 MC = 12,0 g.mol-1 MCa = 40,1 g.mol-1