Cette activité fait suite à la recherche effectuée à la maison pendant les vacances de Noël : lecture des documents et reponses aux questions p 84 ; 234 - 237.
Créer un document Word comportant en en-tête les NOMS des élèves du binôme.
Enregistrer ce document sous sciences physiques 2nde5.
Copier dans le document le résumé suivant puis compléter les phrases suivantes en couleur
1. Un gaz à pression élevée, un liquide ou un solide, s’ils sont chauffés, émettent de la lumière dont le spectre est …………………………………………………………………………………………………………….
2. Un gaz à basse pression, lorsqu’il est excité, émet un rayonnement ………………………………………..
3. Un gaz froid, à basse pression, s’il est situé entre l’observateur et une source de rayonnement continu, absorbe à certaines longueurs d’onde, produisant ainsi des raies (ou bandes) d’absorption dans le spectre continu. Ces longueurs d’onde sont …………………………………………………………………………………..
Informations concernant la lumière émise par les étoiles :
Le rayonnement émis par la surface des étoiles est assimilable, en première approximation, au rayonnement d’un corps à température élevée.
Le spectre de ce rayonnement est généralement centré dans le visible et s’étend parfois dans l’ultra violet.
Le spectre du Soleil et des étoiles présente aussi des raies d’absorption qui caractérisent les éléments chimiques présents dans leurs atmosphères.
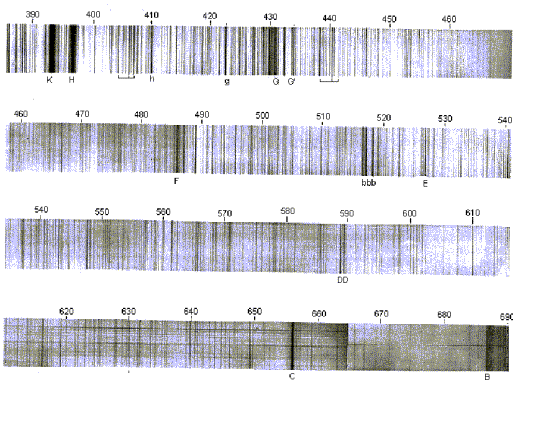
Document 1 : Spectre de la lumière solaire (raies et bandes d’absorption).
Les longueurs d’ondes sont données en nanomètre. Les principales raies d’absorption (les plus intenses) sont désignées par des lettres ou des repères placés sous le spectre.

Le document 2 est un tableau des principales raies spectrales, situées dans le domaine du visible, pour certains des atomes les plus utilisés en astrophysique.
Classement par longueurs d’ondes croissantes
|
l (nm) |
couleur |
atome ou ion |
l (nm) |
couleur |
atome ou ion |
||||
|
388.9 |
U. Violet |
** |
He+ |
516.8 |
Vert |
Fe |
|||
|
393.4 |
U. Violet |
** |
Ca+ |
517.2 |
Vert |
Mg |
|||
|
396.8 |
U. Violet |
* |
Ca+ |
518.4 |
Vert |
** |
Mg |
||
|
403.1 |
Violet |
** |
Mn |
521.8 |
Vert |
* |
Cu |
||
|
404.0 |
Violet |
Fe |
527.0 |
Vert |
Fe |
||||
|
404.4 |
Violet |
* |
K |
540.0 |
Vert |
Ne |
|||
|
404.6 |
Violet |
Hg |
546.1 |
Vert |
* |
Hg |
|||
|
404.7 |
Violet |
K |
553.5 |
Vert |
** |
Ba |
|||
|
406.0 |
Violet |
Fe |
567.9 |
Vert |
** |
N+ |
|||
|
407.6 |
Violet |
Fe |
570.0 |
Vert |
** |
Cu |
|||
|
407.8 |
Violet |
** |
Sr+ |
577.0 |
Jaune |
** |
Hg |
||
|
409.9 |
Violet |
* |
N |
577.8 |
Jaune |
* |
Ba |
||
|
410.2 |
Violet |
Hd |
578.2 |
Jaune |
K |
||||
|
410.9 |
Violet |
* |
N |
579.1 |
Jaune |
** |
Hg |
||
|
422.7 |
Violet |
Ca |
580.2 |
Jaune |
K |
||||
|
424.0 |
Violet |
N+ |
583.2 |
Jaune |
K |
||||
|
425.4 |
Indigo |
** |
Cr |
583.2 |
Jaune |
Ne |
|||
|
427.5 |
Indigo |
* |
Cr |
585.2 |
Jaune |
* |
Ne |
||
|
429.0 |
Indigo |
* |
Cr |
585.7 |
Jaune |
* |
Ca |
||
|
430.8 |
Indigo |
Fe |
587.6 |
Orange |
* |
He |
|||
|
434.0 |
Indigo |
Hg |
588.9 |
Orange |
** |
Na |
|||
|
435.8 |
Indigo |
* |
Hg |
589.5 |
Orange |
* |
Na |
||
|
437.6 |
Indigo |
Fe |
610.3 |
Orange |
* |
Li |
|||
|
440.0 |
Indigo |
Fe |
612.2 |
Orange |
Ca |
||||
|
442.7 |
Indigo |
Fe |
614.2 |
Orange |
* |
Ba+ |
|||
|
444.0 |
Indigo |
N+ |
616.2 |
Orange |
Ca |
||||
|
445.5 |
Indigo |
Ca |
630.0 |
Orange |
Fe+ |
||||
|
447.1 |
Indigo |
He |
636.2 |
Orange |
** |
Zn |
|||
|
455.4 |
Indigo |
** |
Ba+ |
640.2 |
Orange |
** |
Ne |
||
|
455.5 |
Indigo |
* |
Cs |
640.8 |
Rouge |
Sr |
|||
|
460.7 |
Indigo |
** |
Sr |
643.8 |
Rouge |
** |
Cd |
||
|
465.0 |
Indigo |
N+ |
643.9 |
Rouge |
Ca |
||||
|
468.0 |
Bleu |
Zn |
646.2 |
Rouge |
* |
Ca |
|||
|
468.5 |
Bleu |
He+ |
656.3 |
Rouge |
Ha |
||||
|
472.2 |
Bleu |
Zn |
667.8 |
Rouge |
He |
||||
|
480.0 |
Bleu |
** |
Cd |
670.8 |
Rouge |
** |
Li |
||
|
481.0 |
Bleu |
Zn |
671.8 |
Rouge |
Ca |
||||
|
486.1 |
Bleu |
Hb |
691.1 |
Rouge |
K |
||||
|
492.2 |
Vert |
He |
693.9 |
Rouge |
** |
K |
|||
|
493.4 |
Vert |
Ba+ |
706.5 |
Inf Rouge |
He |
||||
|
497.0 |
Vert |
* |
Li |
714.8 |
Inf Rouge |
Ca |
|||
|
500.0 |
Vert |
He |
732.6 |
Inf Rouge |
Ca |
||||
|
500.0 |
Vert |
N+ |
766.5 |
Inf Rouge |
** |
K |
|||
|
501.6 |
Vert |
He |
769.9 |
Inf Rouge |
* |
K |
|||
|
510.5 |
Vert |
* |
Cu |
852.1 |
Inf Rouge |
** |
Cs |
||
|
515.3 |
Vert |
* |
Cu |
894.3 |
Inf Rouge |
Cs |
|||
|
516.7 |
Vert |
Mg |
|||||||
|
** |
raie très intense |
||||||||
|
* |
raie intense |
||||||||
Le document 3 représente une classification spectrale des étoiles due au physicien allemand J. Fraunhofer (1814).
La partie ci-dessous représente des spectres caractéristiques de la classification.

Celle-ci est commentée dans le tableau qui suit.
Classement des étoiles en sept " type spectraux " D'après " L'univers des étoiles " L.Botinelli et J.L. Berthier
|
Type de l'étoile
|
Analyse spectrale |
|
O
|
Présence de raies caractéristiques de l'hélium neutre et ionisé et de l'hydrogène |
|
B
|
Les raies de l'hydrogène sont également présentes mais plus intenses que dans le type O. De nouvelles raies caractéristiques de l'hélium neutre apparaissent, de même qu'une raie de l'ion Mg+ (ex B0 B3) |
|
A
|
Dominé par les raies de l'hydrogène qui atteignent leur maximum d'intensité. Les raies de l'hélium ont disparu. Celles du calcium ionisé apparaissent. (ex. A0 A5) |
|
F
|
Les raies de l'hydrogène sont encore intenses et certaines raies fines de métaux apparaissent. (ex F0 F5) G Les raies du calcium dominent à la limite du violet. On perçoit encore quelques raies de l'hydrogène. Celles du fer se sont nettement renforcées. On note la présence de très nombreuses raies fines de métaux. (ex. G0 G8) |
|
K
|
Les raies de l'hydrogène ont pratiquement disparu. Les raies métalliques sont plus nombreuses et plus intenses. (ex. K5) |
|
M
|
Les raies du calcium atomique et ionisé sont intenses. On note également des bandes de raies caractéristiques de la présence de groupements moléculaires TiO.(ex. M0 M4 M6) |
Le document 4 représente un diagramme permettant de catégoriser les étoiles en fonction de leur température et de leur luminosité (diagramme de Hertzprung-Russel). L’échelle de température est donnée en abscisse en référence aux catégories de Fraunhofer. L’échelle de luminosité est donnée en ordonnée en référence à celle du Soleil.

Répondre aux questions suivantes dans le fichier Word – Enregistrer régulièrement - Imprimer en fin de séance :
a) Identifier les principaux éléments responsables des principales raies d’absorptions présentes dans le spectre de la lumière solaire.
b) Dans quelle catégorie de Fraunhofer se trouve le Soleil ?
c) Placer le Soleil dans le diagramme de Hertzprung-Russel et dire à quelle catégorie d’étoiles il appartient (naines blanches, séquence principale, géantes ou super géantes.)
d) La bande (B) située à l’extrémité du rouge du spectre du soleil (document 2) correspond à une absorption par le dioxygène moléculaire. Y aurait-il du dioxygène à la surface du Soleil ? Mais comment une telle molécule pourrait-elle exister à cette température ? Comment peut-on interpréter la présence de cette bande d’absorption ?
Rédiger une réponse argumentée à ces questions.