Mise en évidence des facteurs cinétiques
Objectifs :
Mettre en évidence deux facteurs expérimentaux influençant la cinétique d’une
réaction chimique
I.
Influence de la température
1. Etude
théorique de l’action des ions peroxodisulfate sur les ions iodure
On veut étudier l’action des ions peroxodisulfate S2O82-
sur les ions iodure I-. Il se forme du diiode I2 qui colore
en jaune une solution très diluée et en brun si la solution est concentrée.
Les deux couples oxydants réducteurs sont :
Ion peroxodisulfate / Ion sulfate S2O82-
/ SO42-
Diiode / Ion iodure
I2 / I-
·
Ecrire les deux demi-équations rédox associées aux couples précédents.
·
En déduire l’équation de l’action des ions peroxodisulfate S2O82-
sur les ions iodure I-.
2. Manipulation
Rédiger un protocole expérimental à soumettre au professeur avant de l’exécuter.
Préciser la liste du matériel utilisé, l’état initial et l’état final des systèmes
considérés. Après avoir réalisé la manipulation, décrire les observations et
énoncer la conclusion.
II.
Influence de la concentration de l’un des réactifs
1. Cas
d’une réaction entre un solide et une espèce en solution :
a.
Etude théorique de l’action des ions oxonium sur le magnésium
On fait réagir, dans une enceinte fermée, les ions oxonium H+aq
contenus dans une solution d’acide chlorhydrique sur le magnésium métallique
Mg. Il se forme alors du dihydrogène gazeux et des ions magnésium Mg2+aq.
b.
Manipulation
Expérience 1
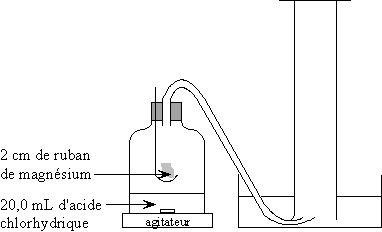
On réalise le montage ci-contre :
·
Verser 20,0 mL d’une solution d’acide chlorhydrique de concentration
[H+aq]=0,5 mol.L-1 dans le flacon. Placer
dans la cuillère 2 cm de ruban de magnésium. Fermer hermétiquement
le flacon. Placer le flacon sous l’éprouvette de façon à recueillir le
gaz formé.
·
Déclencher le chronomètre quand le magnésium est mis dans
la solution d’acide chlorhydrique.
|
|
·
Quelle est la durée pour que la totalité du magnésium réagisse ?
·
Relever le volume de gaz produit.
Expérience 2
Refaire l’expérience avec 20,0 mL d’une solution d’acide chlorhydrique de concentration
[H+aq]=2,0.10-1 mol.L-1.
·
Quelle est la durée pour que la totalité du magnésium réagisse ?
·
Relever le volume de gaz produit.
Interprétation
·
Quelles informations nous apportent les deux expériences précédentes ?
·
Conclure.
2. Cas
d’une réaction entre deux espèces en solution :
a.
Etude théorique de la réaction entre H2O2 et I- :
Les couples mis en jeu sont : H2O2/H2O et
I2/I-. Ecrire l’équation chimique de cette réaction.
b.
Protocole expérimental :
Les solutions utilisées sont :
- une solution d'eau oxygénée à 0,1 mol.L-1
- une solution d'acide sulfurique à 0,5 mol.L-1.
- une solution d'iodure de potassium à 0,2 mol.L-1.
La composition des systèmes est précisée dans le tableau ci-dessous :
Préparer d’abord dans les 3 premiers tubes l’eau oxygénée, l’acide sulfurique
et l’eau distillée, puis dans 3 autres tubes bien repérés les différents volumes
de solution d’iodure de potassium.
Verser simultanément dans les tubes relatifs à chaque expérience le volume
d’iodure de potassium correspondant à l’instant t = 0 où l’on déclenchera le
chronomètre.
|
volumes en mL ®
|
V(H2O2)
|
V(KI)
|
V(H2SO4)
|
V(eau distillée)
|
Vtotal
|
|
Expérience 1
|
5
|
5
|
2
|
8
|
20
|
|
Expérience 2
|
5
|
9
|
2
|
4
|
20
|
|
Expérience 3
|
5
|
13
|
2
|
0
|
20
|
Observer parallèlement les 3 tubes au bout de t = 1,5 min. Noter les observations.
Compléter le tableau suivant :
| |
V(H2O2)
|
V(KI)
|
V(H2SO4)
|
V(eau distillée)
|
Vtotal
|
[I-]0
en mol.L-1
|
[H2O2]0
en mol.L-1
|
Réactif limitant
|
[I2]¥
en mol.L-1
|
|
tube 1
|
|
|
|
|
|
|
|
|
|
|
tube 2
|
|
|
|
|
|
|
|
|
|
|
tube 3
|
|
|
|
|
|
|
|
|
|
Conclure sur cette expérience.
Pourquoi faut-il démarrer les réactions simultanément ?
Quelle est l’espèce dont la concentration varie d’une expérience à l’autre
?
L’espèce dont la concentration varie pourrait-elle être le réactif limitant ?
Pourquoi a-t-on rajouté de l’eau distillée dans 2 des 3 tubes ?
Exercice complémentaire : proposer un protocole faisant varier la concentration
de l’autre réactif.
III.
Conclusion
·
Quels paramètres responsables de la différence d’évolution des
systèmes chimiques ont été mis en évidence ?
·
Enoncer l’influence de chacun de ces paramètres sur la vitesse
d’évolution.
Voir la correction
