Préparation de 10 mL de chacune des quatre
solutions suivantes à partir d’une solution mère S0 de diiode
de concentration [I2]S0 = 5,0.10-3 mol.L-1,
on veut
-
Solution (S1) de concentration
[I2]S1 = 1,0 mmol.L-1
-
Solution (S2) de concentration
[I2]S2 = 2,0 mmol.L-1
-
Solution (S3) de concentration
[I2]S3 = 3,0 mmol.L-1
-
Solution (S4) de concentration
[I2]S4 = 4,0 mmol.L-1
|
S1 |
S2 |
S3 |
S4 |
|
|
Volume de S0 (mL) |
2 mL |
4 mL |
6 mL |
8 mL |
|
Volume d’eau (mL) |
8 mL |
6 mL |
4 mL |
2 mL |
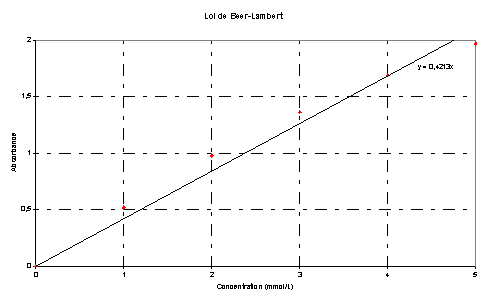
· En utilisant le filtre l = 470 nm, on mesure l’absorbance de chacune des cinq solutions précédentes (S0 à S4) on obtient les résultats suivants.
|
[I2] mol.L-1 |
0 |
1,0.10-3 |
2,0.10-3 |
3,0.10-3 |
4,0.10-3 |
5,0.10-3 |
|
A |
0 |
0,52 |
0,98 |
1,36 |
1,69 |
1,97 |
· Graphe A=f([I2])

· La courbe représentative A=f([I2]) est une droite passant par l’origine ; il y a proportionnalité entre concentration en diiode et absorbance ; il existe une constante k telle que A= k.[I2]. Le coefficient de proportionnalité k = 0,421 si [I2] est exprimée en mmol.L-1
En milieu acide, l’eau oxygénée, solution de
peroxyde d’hydrogène H2O2aq, oxyde les ions iodure I-aq.
Les produits de la transformation sont l’eau et le diiode I2aq.
·
Les couples oxydant / réducteur en présence sont H2O2aq
/ H2O et I2aq / I-aq
·
Les demi - équations formelles
sont : H2O2aq + 2H+ + 2 e- = 2H2O
et I2aq + 2 e- = 2 I-aq
·
L’équation de la transformation est : H2O2aq
+ 2H+ + 2 I-aq ® 2H2O + I2aq . Seul I2
est coloré, l’évolution de sa concentration dans le mélange réactionnel est
suivi par mesure de l’évolution au cours du temps de l’absorbance de la solution.
On fait réagir V1 = 1,0 mL d’une solution d’eau oxygénée de concentration [H2O2aq]=1,0.10-2 mol.L-1 (à 15%) acidifiée et V2 = 1,5 mL d’une solution d’iodure de potassium (K+ + I-) de concentration CKI = 2,0.10-1 mol.L-1.
La concentration [I-aq]
en ion iodure I-aq de la solution d’iodure de potassium
est [I-aq] = 2,0.10-1 mol.L-1, car
la dissolution de KI ® K+aq + I-aq
Les quantités de matière initiales
en réactifs sont n(H2O2aq) = [H2O2aq].V1
= 1,0.10-5 mol.L-1
Les quantités de matière initiales
en réactifs sont n(I-aq) = [I-aq].V2
= 3,0.10-4 mol.L-1
L’équation de la transformation est : H2O2aq
+ 2H+ + 2 I-aq ® 2H2O + I2aq
Tableau d’avancement :
|
H2O2aq |
+ 2 I-aq |
+ 2H+ |
® 2H2O |
+ I2aq |
|
|
Etat initial |
n0 = 1,0.10-5 mol |
n’0 = 3,0.10-4 mol |
excès |
0 |
0 |
|
En cours |
n0 - x |
n’0 –2 x |
2x |
x |
|
|
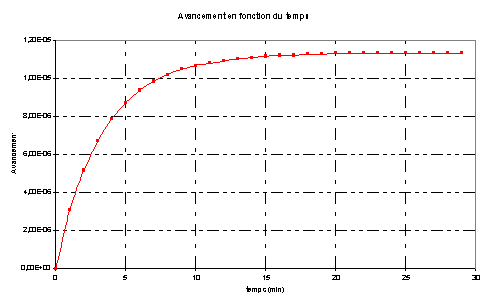
L’avancement final est
atteint pour la plus petite valeur de x permettant d’avoir (n0
– x) = 0 ou (n’0 –2 x) = 0 |
|||||
|
Etat final |
0 |
2,8.10-4 mol.L-1 |
2,0.10-5 mol |
1,0.10-5 mol |
|
Donc n(I2)final = 1,0.10-5
mol. (en théorie)
La concentration finale [I2aq]f
= n(I2)final / ( V1 + V2) = 1,0.10-5
/ 2,5.10-3 = 4,0.10-3 mol.L-1.
|
t (min) |
A mesuré |
C (mmol/L) = A/k |
n(I2) =x = c.( V1 + V2) (attention aux unités !) |
|
0 |
0 |
0,00 |
0,00E+00 |
|
1 |
0,52 |
1,23 |
3,09E-06 |
|
2 |
0,87 |
2,07 |
5,16E-06 |
|
3 |
1,13 |
2,68 |
6,71E-06 |
|
4 |
1,33 |
3,16 |
7,89E-06 |
|
"
|
"
|
"
|
"
|
|
17 |
1,89 |
4,49 |
1,12E-05 |
|
18 |
1,90 |
4,51 |
1,13E-05 |
|
19 |
1,90 |
4,51 |
1,13E-05 |
|
20 |
1,91 |
4,53 |
1,13E-05 |
|
21 |
1,91 |
4,53 |
1,13E-05 |
|
22 |
1,91 |
4,53 |
1,13E-05 |
|
23 |
1,91 |
4,53 |
1,13E-05 |
|
24 |
1,91 |
4,53 |
1,13E-05 |
|
25 |
1,91 |
4,53 |
1,13E-05 |
|
26 |
1,91 |
4,53 |
1,13E-05 |
|
27 |
1,91 |
4,53 |
1,13E-05 |
|
28 |
1,91 |
4,53 |
1,13E-05 |