TP n° 9 Exemples de transformations forcées
I. Objectifs
Montrer que l’électrolyse est une transformation forcée.
Effectuer le bilan quantitatif d’ une électrolyse
II. L’électrolyse : une transformation forcée
1. Rappel sur la transformation spontanée
Dans le système contenant dans des proportions
voisines : Cu ( s ) ; Zn ( s ) ; Cu 2 +(
aq ) ; Zn 2 +( aq ) une réaction spontanée
se produit. Elle est modélisée par l’équation chimique Zn ( s ) +
Cu 2 +( aq ) = Zn 2 +( aq )
+ Cu ( s ) et se traduit par une évolution dans le sens direct,
au cours de laquelle on observe un échange d’électrons entre les réactifs directement
ou à travers un circuit électrique.
2. Exemple de transformation forcée
|
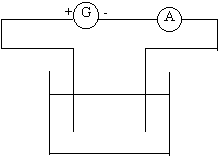
Réaliser le circuit ci-contre en utilisant des électrodes de cuivre et
une solution de sulfate de zinc. Le générateur est un générateur de tension
continue constante égale à 6V.
Le courant passe-t-il ? Dans quel sens ?
Observer, au bout de quelques instants, les électrodes et la solution.
La transformation chimique qui a lieu pendant l’électrolyse peut-elle
être modélisée par la même équation ?
Dans quel sens cette transformation se produit-elle ?
Placer sur le schéma le sens de circulation de tous les porteurs de charge
du circuit.
En déduire les réactions qui ont lieu aux électrodes.
Nommer les électrodes.
|
|
III. Aspect qualitatif : électrolyse d’une solution d’iodure de zinc
1. Expérience
|
Remplir un tube en U avec la solution aqueuse d’iodure de zinc (II) de
concentration molaire 0,25 mol.L-1.
Ajuster la tension aux bornes du générateur à 15 V.
Réaliser le montage comprenant en série : un générateur de tension continue
réglable, un multimètre utilisé en voltmètre, un interrupteur, une électrode
de cuivre (reliée au pôle négatif du générateur) et une électrode de graphite
(reliée au pôle positif du générateur) plongeant dans la solution aqueuse
d’iodure de zinc (II).
Placer environ 1 mL de cyclohexane dans le tube en U du côté de l’électrode
de graphite.
Fermer l'interrupteur. Agiter de temps en temps l’électrode de graphite
Au bout de quelques instants, observer les électrodes et l'aspect du
cyclohexane ajouté.
En déduire les espèces formées lors de l’électrolyse .
|
 Compléter le schéma Compléter le schéma
|
2. Exploitation
Sur le schéma , indiquer le sens de circulation des porteurs de charge dans
tout le circuit.
Faire le bilan des espèces chimiques présentes initialement dans le système,
préciser les couples rédox auxquels appartiennent ces espèces.
Après migration des ions, faire le bilan des espèces susceptibles de réagir
au niveau de chaque électrode.
D’après les observations, indiquer la nature de la réaction à chaque électrode.
En déduire la localisation de l’anode et de la cathode.
Ecrire l’équation chimique de la réaction globale dans le sens direct d’évolution.
IV. Aspect quantitatif : électrolyse de l’eau en milieu basique
1. Expérience
|
Réaliser le montage en série comprenant : un générateur de tension continue
réglable, un électrolyseur, un multimètre utilisé en mode ampèremètre,
un interrupteur.
Introduire la solution de soude dans l'électrolyseur. (les électrodes
doivent être largement couvertes)
Ajuster la tension aux bornes du générateur pour que l’intensité du courant
soit égale à une valeur de l’ordre de 0,3 A.
Avec des gants remplir les tubes gradués avec de l'eau distillée et les
retourner, sans bulles d'air, sur les électrodes.
Fixer les tubes gradués en les relevant légèrement au-dessus des électrodes.
Fermer l'interrupteur tout en déclenchant le chronomètre.
|

|
Relever la valeur de l'intensité du courant et la maintenir constante.
Arrêter l'électrolyse, lorsque le volume dégagé à une électrode est important.
Noter la durée totale de l'électrolyse.
Mesurer les valeurs des volumes dégagés à l'anode et à la cathode.
Identifier les gaz formés.
Relever la valeur de la température du laboratoire et de la pression atmosphérique.
2. Exploitation
Calculer le volume molaire des gaz parfaits à la température et à la pression
du laboratoire
Indiquer sur le schéma la circulation de tous les porteurs de charge du circuit
Faire l’inventaire des espèces initialement présentes en solution.
Faire le bilan des espèces présentes susceptibles de réagir au niveau de chaque
électrode, après migration des ions.
Donner l’expression de la quantité d’électricité qui a circulé pendant la durée
t en fonction de l’intensité du courant
Etablir le tableau descriptif de l’évolution du système à l’anode
En déduire la quantité d’électrons qui a circulé pendant la durée de l’électrolyse
.
Ecrire l’équation de la réaction associée à l’électrolyse. D’après les observations,
dans quel sens l’évolution se produit-elle ?
Vérifier que le rapport des volumes dégagés est en accord avec le rapport des
quantités de matière à l’état final.
Données :
Couples oxydant / réducteur : O 2 ( g ) / HO – (aq)
; H 2 O / H 2 (g) ; Na +(aq)
/ Na (s)
Constante des gaz parfaits : R = 8,32 J.K – 1 . mol –
1

 Compléter le schéma
Compléter le schéma