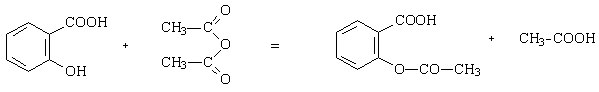TP 12 Hémisynthèse de l’aspirine
C’est en 1897 que Félix Hoffmann, jeune chimiste allemand
travaillant pour la firme Bayer synthétise pour la première fois l’acide acétylsalicylique
(aspirine). Cette substance est un médicament, anti-pyrétique, anti-inflammatoire
et analgésique. Il possède également des propriétés anti-coagulantes.
I. Les fonctions organiques de l’aspirine :
|
La formule semi-développée de l’aspirine est
la suivante : quels groupes fonctionnels organiques peut-on identifier
dans cette molécule ?
|
|
|
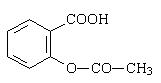
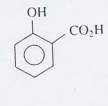
Pourrait-on synthétiser l’aspirine à partire
d’acide salicylique (ci-contre) ?
Quel autre réactif faudrait-il ?
Écrire l’équation chimique de la transformation.
Quels sont les inconvénients de ce protocole ?
II. Le TP:
|
|
1. Présentation
de la démarche
Le protocole proposé permet de réaliser une étape
de la synthèse de l’aspirine à partir de l’acide salicylique et de l’anhydride
acétique. Cette réaction (catalysée par les ions H+) et qui conduit
à un ester n’est pas à proprement parler une estérification. Elle présente l’avantage
d’être totale.
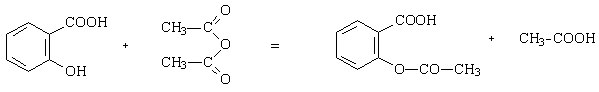
acide salicylique anhydride
aspirine
(acide 2-hydroxybenzoïque) éthanoïque(acétique) acide acétylsalicylique
2. Protocole
expérimental
|
·
Dans un erlenmeyer de 125 mL, introduire 5g d’acide salicylique,
puis muni de gants et de lunettes, 6 mL d’anhydride éthanoïque mesurés
à l’éprouvette graduée. Ajouter avec précaution, 3 à 4 gouttes d’acide
sulfurique concentré.
·
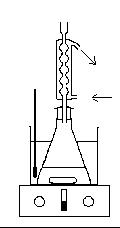
Adapter un réfrigérant à boules et chauffer sur agitateur
chauffant, au bain-marie maintenu entre 50 et 60 °C ( thermostat 200 )
pendant 10 à 15 minutes tout en agitant.
·
Retirer le bain-marie, maintenir l’agitation et la circulation
d’eau dans le réfrigérant. Verser par petites quantités, par le sommet
du réfrigérant 5 mL d’eau distillée , puis deux fois 20 mL d’eau glacée
afin de détruire l’excès d’anhydride éthanoïque par hydrolyse.
·
Retirer le barreau aimanté, puis placer l’erlenmeyer dans
la glace jusqu’à la cristallisation complète de l’aspirine.
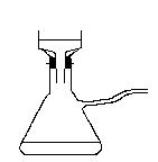
· A l’aide d’un agitateur en verre, écraser
les grumeaux qui ont pu se former et filtrer sur Büchner en tirant sous
vide à l’aide de la trompe à eau.
|
|
|
·
Laver avec un peu d’eau froide qui aura servi à rincer l’erlenmeyer
·
Aspirer à nouveau
·
Prélever une pointe de spatule du produit obtenu et le placer
dans un tube à essai
·
Transvaser les cristaux dans un verre de montre préalablement
pesé et sécher à l’étuve à 80 °C.
·
Peser le produit sec
|
|
|
|
|
3. Caractérisation
du produit obtenu
On réalisera une chromatographie sur couche mince des solutions dans l’éthanoate
(acétate) d’éthyle (1 pointe de spatule dans 1 mL de solvant) de :
1 : acide salicylique 2 : aspirine 3 : produit synthétisé
·
Préparer la cuve à élution. L’éluant est un mélange d’éthanoate
d’éthyle, cyclohexane, acide méthanoïque
·
Préparer les solutions des espèces à déposer.
·
Faire les dépôts puis placer la plaque dans la cuve à élution.
·
Révéler sous UV. Entourer les taches d’un léger trait de crayon
les taches visibles sous lumière UV.
4. Exploitation
- Légender les schémas des montages. Comment nomme-t-on le premier dispositif ?
Quel est son intérêt ?
- Calculer les quantités de matière des réactifs mis en jeu. En déduire le
réactif limitant (On donne la masse volumique de l’anhydride éthanoïque :
r = 1,08 g.mL – 1 )
- Calculer la masse maximale d’aspirine attendue.
- En déduire le rendement maximum de la réaction.
- Quels sont les moyens mis en jeu pour augmenter la vitesse de la réaction ?
- Au vu de la réaction, pourquoi l’hydrolyse de l’aspirine ne peut-elle pas
avoir lieu ?
- Écrire la réaction d’hydrolyse de l’anhydride éthanoïque en excès.
- Quelles sont les espèces chimiques présentes dans le filtrat après la cristallisation
et la filtration
- Exploiter le chromatogramme. Le produit obtenu est – il pur ? Sinon,
quelle(s) impureté(s) contient – il ?
- Comment explique t –on la présence des impuretés ?
Données :
Acide salicylique : solide blanc, peu soluble dans l’eau à froid,
soluble à chaud.
Acide acétylsalicylique ( aspirine ) : solide blanc, solubilité
dans l’ eau à 25°C :3,3 g / L .