 En
chromatographie sur couche mince ou sur papier, on définit le rapport frontal
R f qui est une caractéristique d’ une espèce chimique dans un éluant
donné et sur un support donné .
En
chromatographie sur couche mince ou sur papier, on définit le rapport frontal
R f qui est une caractéristique d’ une espèce chimique dans un éluant
donné et sur un support donné .Résumé des notions vues en spécialité chimie
Une solution est obtenue en dissolvant dans un solvant en général liquide, un soluté solide, liquide ou gaz.
Certains atomes ont la propriété d’attirer les électrons des liaisons qu’ils font avec d’autres atomes : ils sont électronégatifs
Une liaison de covalence est polarisée si les atomes qu’ elle relie ont des électronégativités différentes. C’est le cas des liaisons O-H dans H2O.
Une molécule est polaire si les barycentres des charges positives et des charges négatives ne sont pas confondus. L’eau est un solvant polaire.
Les composés ioniques et les composés moléculaires polaires sont généralement solubles dans les solvants polaires.
Exemple : l’eau dissout les composés ioniques comme le chlorure de sodium
et les molécules polaires comme l’éthanol CH3CH2-OH et l’ acide éthanoïque CH3COOH
Les composés apolaires sont généralement solubles dans les solvants apolaires (non polaires). Exemple : les solvants organiques (dichlorométhane , cyclohexane…) dissolvent les molécules apolaires (alcanes…)
Une molécule peut présenter des parties dont la solubilité est différente. Exemple : Les acides carboxyliques présentent une extrémité polaire et une chaîne carbonée apolaire. Leur solubilité dans l’eau dépend de la longueur de la chaîne carbonée
Si deux solvants ne sont pas miscibles, leur mélange présente deux phases distinctes.
Alors celui qui surnage est celui qui a la plus faible densité
C’est la distillation d’un mélange hétérogène d’eau et d’un liquide organique non miscible à l’eau. Portée à ébullition, l’eau s’évapore entraînant les substances les plus volatiles du mélange. On obtient un distillat qui présente deux phases.
Elle consiste à faire passer un soluté d’un solvant dans un autre où il est plus soluble. Les deux solvants doivent être non miscibles. En général le soluté se distribue dans les deux solvants en fonction de sa solubilité dans chacun d’eux . Les deux liquides sont séparés par décantation dans une ampoule à décanter
Elle consiste à faire tremper une substance dans un solvant le plus souvent à chaud pour en extraire les espèces solubles dans le solvant utilisé.
Exemple : extraction des parfums de certaines fleurs par macération dans des solvants organiques.
La chromatographie permet de séparer et d’identifier les espèces chimiques d’un mélange. Elle utilise leur différence d’affinité pour deux phases : la phase stationnaire, ou phase fixe (liquide ou solide) et la phase mobile appelée éluant (liquide ou gaz). Les espèces chimiques sont d’ abord fixées sur la phase stationnaire puis déplacées sélectivement par l’éluant
La phase stationnaire est un solide doué de propriétés adsorbantes (¹ absorbantes ! il se forme à la surface du solide des liaisons avec les molécules d’un composé) : alumine ou gel de silice retiennent les composés les plus polaires. La phase mobile est un liquide (mélange de solvants) ou un gaz.
La phase stationnaire est fixée sur une feuille de plastique ou d’aluminium. On dépose une goutte de chaque échantillon à analyser. L’éluant migre par capillarité entraînant les espèces chimiques du mélange selon leur polarité. Plus une espèce est soluble dans l’éluant plus elle sera entraînée. Plus cette espèce est adsorbée sur la phase fixe moins sa vitesse de déplacement sera grande.
La phase fixe solide remplit une colonne en haut de laquelle on dépose l’échantillon à analyser. La séparation des constituants du mélange résulte de l’écoulement continu de l’éluant , traversant la colonne sous l’effet de la gravité . Des fractions sont recueillies en bas de la colonne. La chromatographie sur colonne permet d’ isoler effectivement chaque constituant du mélange.
La phase stationnaire est un liquide adsorbé à la surface d’un support solide inerte. La séparation repose sur les différences de solubilité des constituants du mélange dans la phase fixe et dans la phase mobile.
La chromatographie sur papier filtre ou buvard est une chromatographie de partage. La phase stationnaire est
l’eau adsorbée par la cellulose du papier ou liée chimiquement à elle. La phase mobile est souvent un mélange d’eau et d’un solvant organique miscible à l’eau. Les composés les plus solubles dans l’eau migrent lentement.
En chromatographie sur couche mince ou sur papier, les taches incolores du chromatogramme doivent être révélées (rendues visibles)
ð révélation par les UV :
Les plaques doivent être fluorescentes aux UV , les espèces absorbant les UV empêchent la fluorescence et apparaissent sous forme de taches sombres
ð révélation par le permanganate de potassium :
Pour les molécules présentant un site oxydable (alcool primaire et secondaire, aldéhyde, double liaison). Les espèces apparaissent sous forme de taches jaunes sur fond rose
ð révélation par le diiode :
La plaque est introduite dans une cuve saturée en vapeurs de diiode. Il se forme des complexes bruns avec de nombreuses espèces organiques en particulier insaturées (c’est à dire comportant des doubles liaisons).
ð révélation par réactif pulvérisé :
DNPH révèle les composés carbonylés à taches jaunes
Ninhydrine révèle les acides aminés à taches violettes
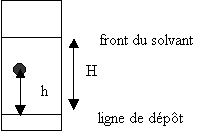
 En
chromatographie sur couche mince ou sur papier, on définit le rapport frontal
R f qui est une caractéristique d’ une espèce chimique dans un éluant
donné et sur un support donné .
En
chromatographie sur couche mince ou sur papier, on définit le rapport frontal
R f qui est une caractéristique d’ une espèce chimique dans un éluant
donné et sur un support donné .
distance parcourue par l’ espèce chimique
h
R f = --------------------------------------------
= -----
distance parcourue par l’ éluant H