Devoir commun TS2 / TS3
Physique 1 (5 points): L’iode 131
En 1986 lors de la catastrophe de Tchernobyl,
l'explosion d'un réacteur nucléaire a provoqué la libération dans l'atmosphère
d’un certain nombre de noyaux radioactifs dont l'iode (I) 131. Ce nucléide est
radioactif b- de demi-vie 8 jours et donne naissance à un noyau
stable. En cas d’inhalation, l'iode 131 se fixe sur leur glande thyroïde et
y provoque des lésions pouvant induire des cancers lors de sa désintégration.
Pour éviter cette contamination, on fait ingérer aux individus potentiellement
exposés à une source d’iode 131, des pastilles d’iode 127 stable afin de saturer
leur glande tyroïde et d’éviter la fixation de l’isotope radioactif.
1. Quelles lois de conservation doivent être
respectées lors d’une réaction nucléaire ?
2. Ecrire l’équation de la désintégration
de ce noyau. Préciser la nature du noyau fils.
3. Rappeler l’expression de la loi de
décroissance radioactive d’un noyau radioactif en précisant la signification
de tous les termes.
4. Quel pourcentage de la population
d’iode 131 initialement émise restait-t-il six mois après la catastrophe ?
5. Les conséquences à long terme de cette catastrophe vous semblent-elles dues
à l’iode 131 ?
6. L’iode 131 est utilisée en médecine pour l’examen des dysfonctionnements
de la glande tyroïde. Suivant une prescription médicale, on injecte au patient
de l’iode 131 qui se fixe sur sa glande tyroïde, la détection des rayonnements
émis lors de la désintégration permet de réaliser des images de la glande. Au
moment de l’injection, l’activité de la tyroïde passe à 37 MBq. Quelle est son
activité le lendemain de l’examen ?
7. Le patient travaille dans le domaine de l’industrie nucléaire. Des
détecteurs à l’entrée et à la sortie de son lieu de travail permettent de contrôler
son exposition aux rayonnements radioactifs dans le cadre professionnel. Une
sonnerie se déclenche si le détecteur perçoit une activité supérieure à 5.106
Bq. Combien de temps après l’examen de sa tyroïde pourra-t-il passer devant
le détecteur sans le déclencher ?
Données :
|
Nom
|
Antimoine
|
Tellure
|
Iode
|
Xénon
|
Césium
|
|
Symbole
|
Sb
|
Te
|
I
|
Xe
|
Cs
|
|
Numéro atomique
|
51
|
52
|
53
|
54
|
55
|
Physique 2 (5 points): Mesure de la capacité d’un condensateur
|
On considère le montage ci-contre (cf.
figure 1) composé :
- d'un générateur de tension de force électromotrice E = 2 V dont
la masse est isolée de la terre.
- d'un condensateur de capacité C inconnue
- d'un conducteur ohmique de résistance
R = 20 W
- d'un interrupteur.
- d'un ordinateur utilisé en oscilloscope
à mémoire.
Le sens du courant représenté sur
le schéma est le sens conventionnel.
Le condensateur est initialement
déchargé.
1. Représenter par une flèche sur
le schéma la tension visualisée par l’ordinateur.
2. L’enregistrement de la tension aux bornes du condensateur en
fonction du temps donne le graphique de la figure 2. Expliquer le phénomène
et commenter l'allure de la courbe obtenue.
|

figure 1
|
|
3. Mesurer en faisant apparaître sur
le schéma la méthode utilisée, la constante de temps du circuit.
4. En déduire une valeur approchée de la capacité C du condensateur.
5. Exprimer uR la tension aux
bornes du conducteur ohmique, en fonction de uC et E.
6. Représenter sur le schéma ci-contre
l’évolution de uR au cours du temps.
7. Exprimer uR en fonction
de R et de i, en déduire les valeurs de l'intensité du courant au début
et à la fin de la charge.
|
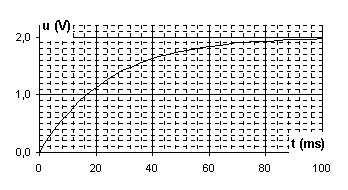
Figure 2
|
|
|
|
Chimie (11 points): L’aspirine un « comprimé
de chimie »
Extrait du dictionnaire des « médicaments conseil grand public »
concernant l’Aspirine du Rhône 500 :
° disponible
sous deux formes : Comprimés en boîtes de 30 ou 100 comprimés
Comprimés à croquer, ambulatoire et facile à transporter
° Composition par comprimé :
Acide acétylsalicylique : 500 mg
Excipient : amidon de blé, gel de silice
|
Données :
Masses molaires atomiques :
M(C) = 12 g.mol-1 ;
M(O) = 16 g.mol-1; M(H) = 1 g.mol-1
Conductivités molaires ioniques :
lH3O+ = 34,985 mS.m².mol-1 lA‑ = 3,5 mS.m².mol-1
Masse molaire moléculaire
de l’aspirine (acide acétylsalicylique) : 180 g.mol-1.
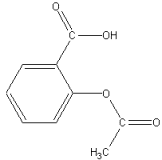
formule moléculaire simplifiée ci-contre
Toutes les mesures se font à une température de 25°C.
L’acide acétylsalicylique sera noté AH et sa base
conjuguée A‑.
|
|
Partie A : Propriétés
de l’aspirine
1. Entourer le groupement caractéristique de
la fonction acide carboxylique. Montrer que ce groupement présente une acidité
au sens de Brønsted.
2. Ecrire la formule simplifiée de l’ion
acétylsalicylate, base conjuguée de l’aspirine.
3. Ecrire l’équation de la réaction de
l’eau avec l’aspirine.
4. Déduire du tableau d’avancement de
la réaction une relation entre les concentrations à l’équilibre des ions acétylsalicylate
[A‑]eq et oxonium [H3O+]eq.
|
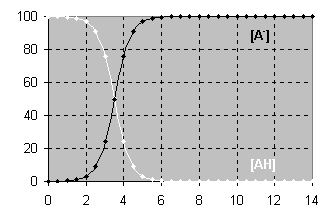
5. A partir du diagramme de distribution
ci-contre, déterminer le pKA du couple AH / A‑
6. On veut vérifier cette valeur par mesure de conductimétrie.
La constante de cellule du conductimètre utilisé est :
kcell = Gétalon/ sétalon = 0,841 cm.
Indiquer le protocole expérimental
pour déterminer la constante de cellule d’un conductimètre.
7. La conductance d’une solution
aqueuse d’aspirine de concentration c = 5,0.10-3 mol.L-1
est égale à G = 3,59.10-4 S. Déterminer la valeur
de [H3O+]eq, [A‑]eq
et [AH]eq
8. En déduire la constante
d’acidité du couple AH/A‑.
|
|
9. Calculer le pKA du couple. Comparer
à la valeur trouvée précédemment.
10. Déterminer le taux d’avancement final
t de la réaction précédente. Conclure.
11. Calculer la valeur du pH de cette
solution ?
Partie B : Vérification de la composition d’un
comprimé Aspirine du Rhône
On dissout un comprimé d’aspirine 500 dans
500 mL d’eau. On obtient la solution S1. On titre 100 mL de
la solution S1 par une solution S2 d’hydroxyde de sodium
de concentration c2 = 5,0.10‑2 mol.L-1
1. Faire un schéma annoté du montage.
2. Choisir parmi les équations chimiques suivantes celle qui est associée
à la transformation du système étudié lors du titrage. Justifier la réponse :
H3O+(aq) + HO-(aq)
® 2 H2O(l)
AH(aq) + H2O(l) ®
H3O+(aq) + A-(aq)
AH(aq) + HO-(aq)
® H2O(l)
+ A-(aq)
H3O+(aq) + HO-(aq)
= 2 H2O(l) AH(aq) + H2O(l)
= H3O+(aq) + A-(aq)
AH(aq) + HO-(aq)
= H2O(l) + A-(aq)
3. Les mesures de pH lors du titrage ont permis
d’obtenir la courbe suivante :
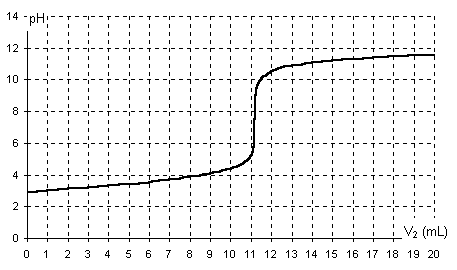
Titrage de 100 mL de la solution
S1
Déterminer graphiquement, en faisant apparaître
la méthode sur le schéma, les coordonnées du point d’équivalence acido-basique.
4. Entre AH et A-, quelle
est l’espèce majoritaire à l’équivalence ? Justifier.
5. Déterminer n1 la quantité
de matière de réactif titré initialement apporté dans le bécher et n2,E
la quantité de matière de réactif titrant versé à l’équivalence.
6. Quelle est la relation liant n1
et n2,E.
7. En déduire la concentration c1
en aspirine dans la solution S1.
8. Vérifier que l’indication concernant
la composition du comprimé est correcte.




